近日,双抗药物市场热浪不断:康方生物与Summit Therapeutics达成双抗产品AK112最高50亿美元的海外授权交易,国内双抗研发企业武汉友芝友生物递交IPO上市申请......市场利好驱动下,双抗药物也迎来研发热潮。目前国内大约有80款双抗处于临床阶段,信达生物、石药控股、罗氏等拥有4款及以上在研产品,恒瑞医药的SHR-1701、百济神州的Zanidatamab等13款产品处于Ⅲ期临床,基于CD47/PD-L1靶点的双抗最为火热,有5款产品正在开展临床试验......针对双抗肿瘤药物临床研发中亟需关注的问题,CDE制定了系列指导原则,以指导企业更加科学地进行双抗临床研发。

来源:CDE官网双特异性抗体(BsAb,以下简称“双抗”)是通过细胞融合、重组DNA、蛋白质工程等技术制备的人工抗体,可以同时或先后特异性结合2种抗原或同一抗原的两个不同表位。
双抗作为一类具有双功能的“单药”,既不同于有关的单抗,也不同于单抗的联合用药。单抗类抗肿瘤药物的临床研发思路与技术要求已较为成熟,但针对多种抗原表位的双抗药物,由于结构与功能存在特殊性,在临床研发中,有其特殊考虑要点。
经总结,《双特异性抗体抗肿瘤药物临床研发技术指导原则》为相关研发企业提供了3个关键参考要点:
① 普遍认为双抗的药效学或生物学作用机制主要包括:桥联细胞、桥联受体、桥联因子;
② 在治疗方面,与单抗相比,双抗可能存在介导免疫细胞对肿瘤的杀伤、增强对免疫细胞的激活、双靶点信号阻断防止耐药、介导更强的内吞作用等潜在优势;
③ 双抗可能以具有生物活性和非活性形式的混合状态存在,此外具有多个结构域,以不同方式介导临床疗效,因此,选择双抗的最佳给药策略需要考虑与两个靶点相关的靶标结合,以及结合动力学对疗效安全性的影响。
全球9款、国内3款,双抗领域前景广阔
与传统单抗相比,双抗优势在于拥有更加精准的靶向和更强的治疗效果,理论上双抗可以发挥“1+1>2”的作用。正是因为其巨大的治疗潜力,双抗药物前景广阔,逐渐成为新药研发和投资的“新宠”。
全球双抗获批上市情况
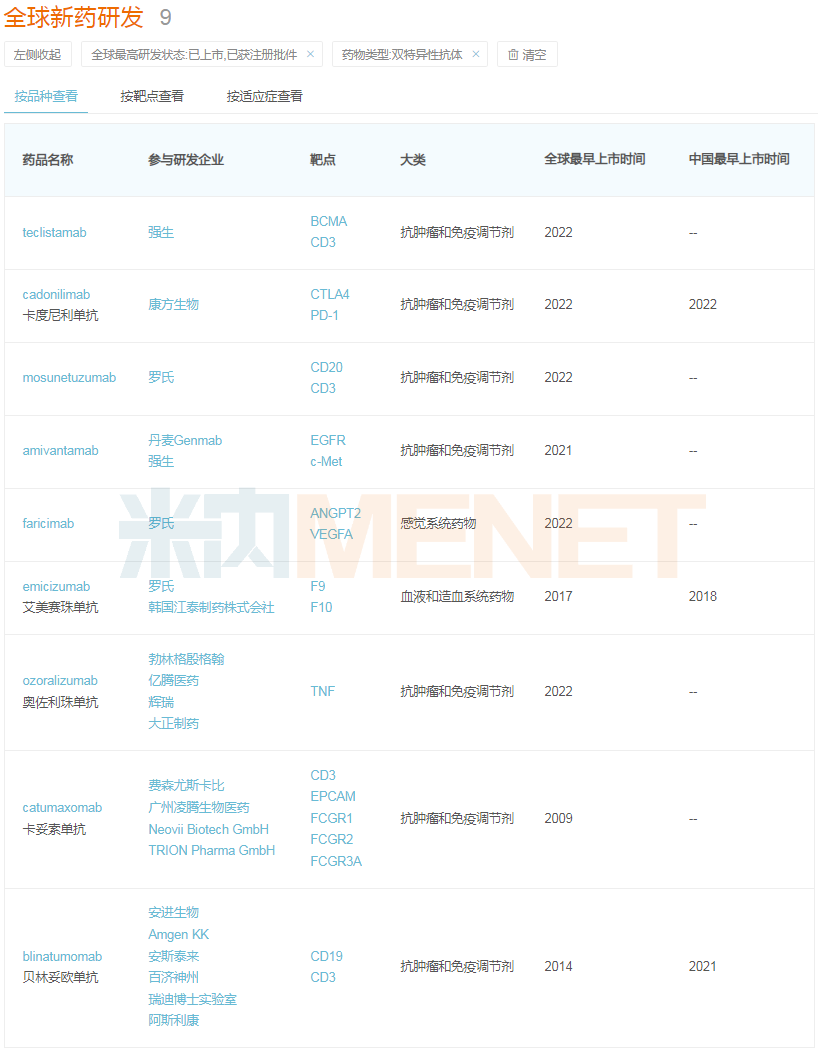
来源:米内网新版数据库
目前全球共9款双抗药物获批上市,包括罗氏的艾美赛珠单抗及Faricimab、安进生物的贝林妥欧单抗、费森尤斯卡比的卡妥索单抗、康方生物的卡度尼利单抗、强生的Amivantamab、勃林格殷格翰的奥佐利珠单抗等。其中,罗氏的艾美赛珠单抗、安进生物的贝林妥欧单抗以及康方生物的卡度尼利单抗先后在中国市场登陆。
近年来中国三大终端6大市场艾美赛珠单抗、贝林妥欧单抗销售趋势(单位:万元)
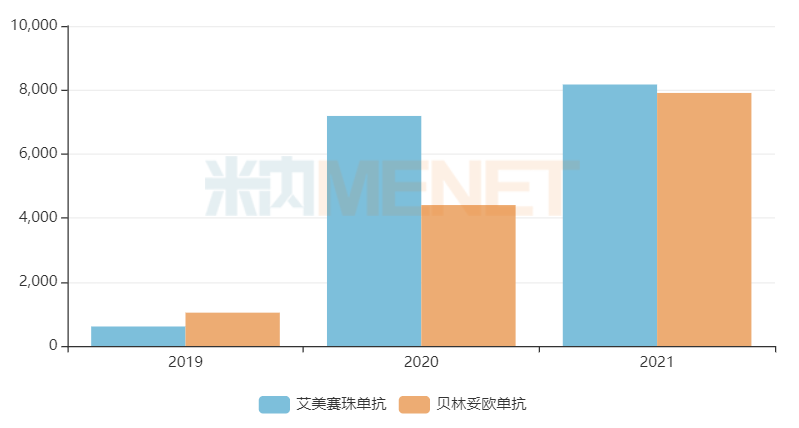
来源:米内网格局数据库
罗氏的艾美赛珠单抗、安进生物的贝林妥欧单抗分别于2018年11月、2020年12月获NMPA批准上市,均以“符合儿童生理特征的儿童用药品新品种、剂型和规格”纳入优先评审。米内网数据显示,上述产品2021年在中国三大终端6大市场销售额均接近1亿元,分别同比增长13.67%、79.52%。
康方生物的卡度尼利单抗于2022年6月获NMPA批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者,是国内首款、全球首创的PD-1/CTLA-4双特异性免疫治疗药物,也是2022年国谈的热门抗肿瘤药物。
近80款在研双抗蓄势待发,信达、恒瑞……掘金2000亿市场
近年来,随着多个双抗药物的成功上市,以及生物制药技术的不断进步,双抗药物开始步入高速发展阶段,研发热度持续高涨。据米内网统计,目前国内已有近80款双抗药物处于申报临床及以上的研发状态,超过37家国内药企参与布局。
处于临床试验阶段双抗药物达到3款及以上的国内药企
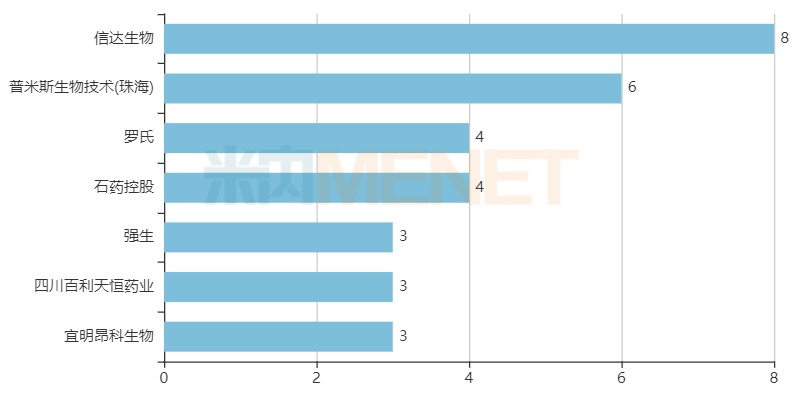
来源:米内网新药研发数据库
从数量上看,信达生物是双抗研发领域的“领军者”,共有8款产品处于临床试验阶段,其中拟用于治疗湿性年龄相关性黄斑变性的IBI-302、以及拟用于治疗T细胞淋巴瘤、皮肤癌的IBI-318已进入Ⅱ期临床。普米斯生物技术(珠海)有6款双抗处于临床试验阶段,其中2款抗肿瘤药PM-8001、PM-8002已进入Ⅱ期临床。除此之外,处于临床试验阶段双抗药物达到3款及以上的药企还有罗氏(4款)、石药控股(4款)、强生(3款)、四川百利天恒药业(3款)、宜明昂科生物(3款)。
国内双抗在研情况
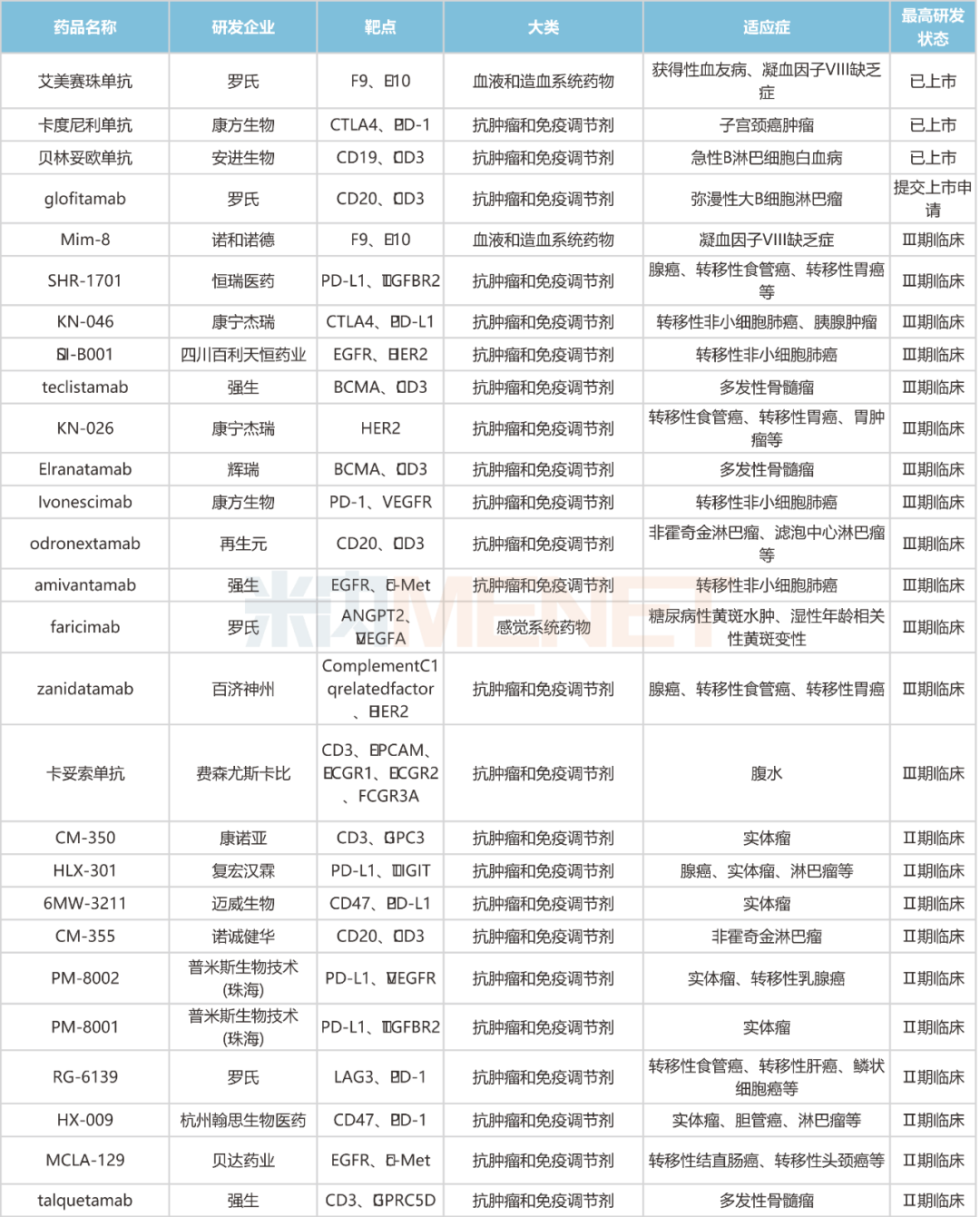
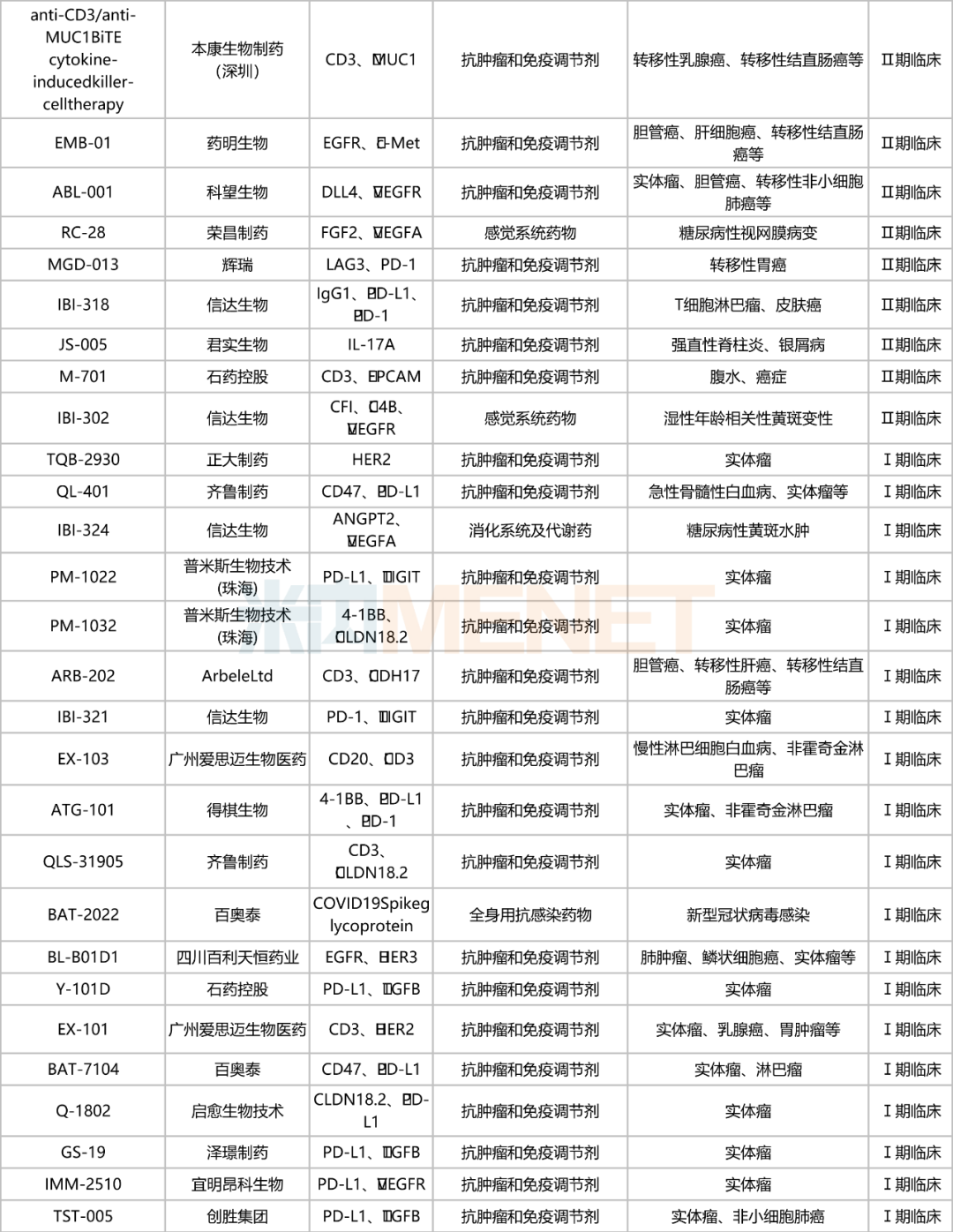
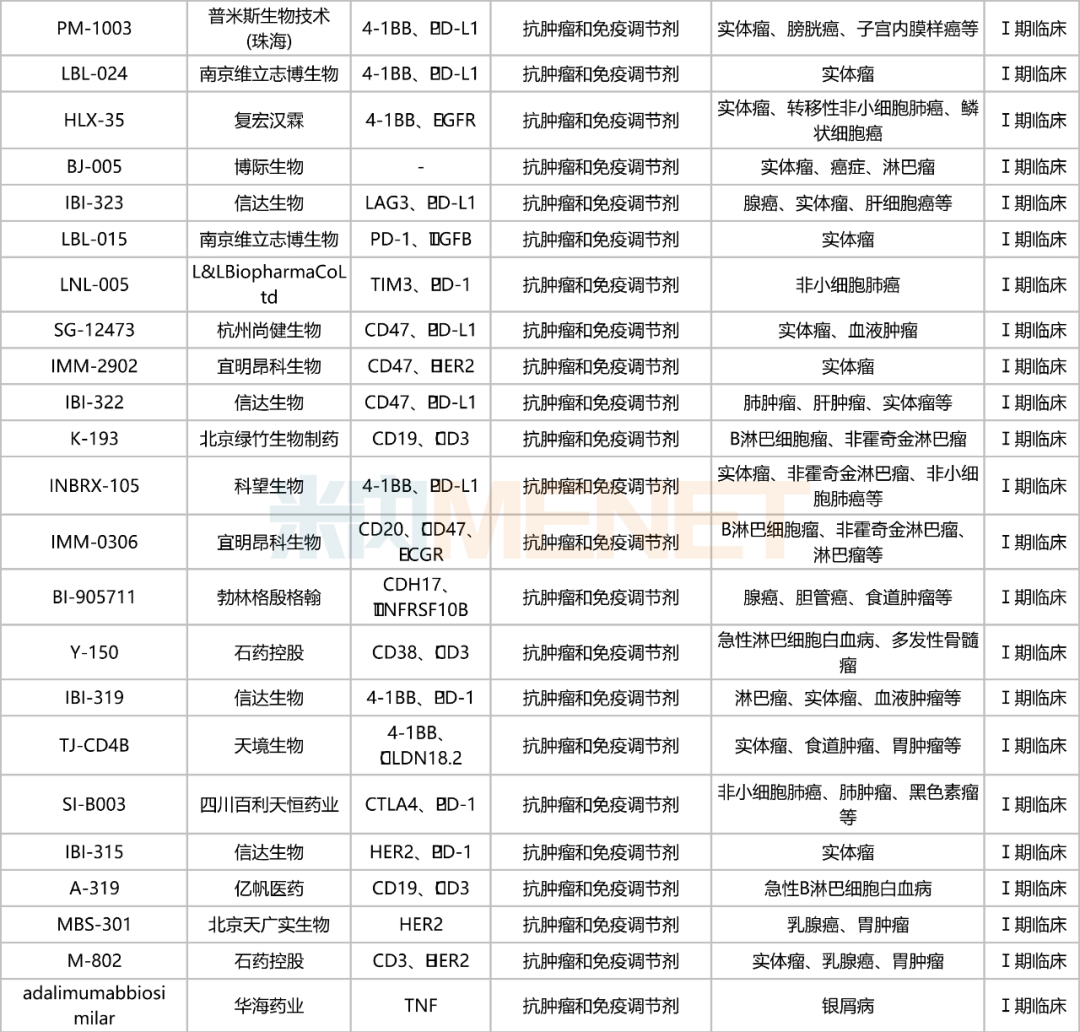
注:仅统计申请临床及以上阶段
来源:米内网新药研发数据库
从靶点研发热度上看,CD47/PD-L1是国内在研双抗最热门的组合。CD47/PD-L1双抗能同时激活天然免疫和获得性免疫双通路,增强免疫系统对肿瘤的定向识别,协同抗肿瘤;更能同时靶向肿瘤上CD47和PD-L1,精准导航瞄准肿瘤组织,减少毒性,可谓“强强联手、安全有效”。目前,国内已有5款CD47/PD-L1双抗处于临床试验阶段,包括迈威生物的6MW-3211、齐鲁制药的QL-401、百奥泰的BAT-7104、信达生物的IBI-322以及杭州尚健生物的SG-12473,其中,迈威生物的6MW3211(受理号:CXSL2101058)进度较快,已步入Ⅱ期临床。
从研发进度分析,恒瑞
医药的SHR-1701、百济神州的Zanidatamab、康方生物的Ivonescimab、康宁杰瑞的KN-046等13款双抗正开展Ⅲ期临床试验,报产将指日可待。其中,恒瑞医药的SHR-1701是研发进度最快的PD-L1/TGFB双抗,若该药成功获批,有望成为同类产品的“first-in-class”。百济神州的Zanidatamab属于HER2双抗,此前已获FDA授予用于HER2基因扩增胆道癌(BTC)患者的突破性治疗认定,以及用于治疗胆道癌和胃癌的孤儿药认定,有望进一步推动国内上市进程。
近年来中国三大终端6大市场抗肿瘤和免疫调节剂销售情况(单位:万元)
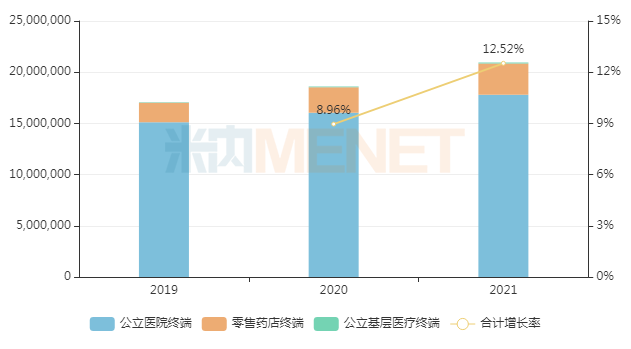
来源:米内网格局数据库
从治疗大类上看,抗肿瘤和免疫调节剂居多,共有71款药品正在开展临床研究;感觉系统药物有3款,血液和造血系统药物有2款,消化系统及代谢药、全身用抗感染药物各有1款均已进入临床试验阶段。米内网数据显示,抗肿瘤和免疫调节剂2021年在中国三大终端6大市场的销售规模突破2000亿元,同比增长12.52%,预计2022年有望再创新高。
三大要点助力研发企业弯道突围
大热的双抗药物研发赛道,中国药企该如何突围、实现弯道超越?笔者认为可从“靶点筛选、工艺提升、研发加速”三个方面入手:
① 着力生物机制和靶点筛选双靶点会引起更复杂的作用机制,可能会带来潜在的未知安全隐患,这些风险在临床前研究时很难被预测。研究者必须要对配对的靶点有深刻的理解,筛选出合适的双抗基础结构,并且满足亲和力、药代动力学的各种指标,结构改动越少的双抗具备更合适的稳定性和溶解度,更易实现“1+1>2”的效果。
② 提升抗体开发及工艺技术在技术层面,双抗的技术难点在于结构设计和链的匹配,这并非两个单抗联合在一起就能解决的问题,随着国家药监局对于以临床需求为导向的指导,过去意图通过简单的联合就研发出双抗的时代已不复存在。以临床需求为导向的大趋势,将倒逼研发企业的双抗平台需具备易于后续
药品开发的特性,以及稳定高效的抗体技术;在工艺层面上,持续优化结构将有利于双抗的提纯。
③ 缩短研发周期,为产品商业化赢取先机任何市场、任何产品,赢得先发优势是至关重要的,双抗领域也不例外。因此,被选择的候选药物要满足临床试验和开发的多个标准,即满足临床疗效,高安全性,药效/药代动力学参数合适,良好的物化性质,可放大生产,免疫原性低等。具有优良性质的双抗显然可以降低CMC(药品的化学、制造和控制)开发难度并缩短研发周期,为产品商业化赢得先机。
结语
双抗药物是单抗药物的升级产品,并逐渐成为肿瘤及免疫治疗药物的重要发展方向。现阶段全球及国内多个药企对双抗药物的研发极为重视,已研发问世并进入临床的药物种类不断增多。在临床研发中,我们后续需要关注首次人体临床试验的风险控制、最佳给药策略、免疫原性、生物标志物的开发等问题。随着双抗药物陆续获批上市,同时已上市双抗获批更多适应症,数据预测显示,双抗的全球市场规模在2025年将超过500亿元。市场前景一片趋好的形势下,后来者想要在火热的双抗赛道上突围而出,减少同质化竞争、寻求差异化产品显然是必不可少的。
来源:米内网数据库、CDE官网注:米内网《中国三大终端6大市场药品竞争格局》,统计范围是:城市公立
医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体
药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至12月9日,如有疏漏,欢迎指正!
 来源:CDE官网双特异性抗体(BsAb,以下简称“双抗”)是通过细胞融合、重组DNA、蛋白质工程等技术制备的人工抗体,可以同时或先后特异性结合2种抗原或同一抗原的两个不同表位。
双抗作为一类具有双功能的“单药”,既不同于有关的单抗,也不同于单抗的联合用药。单抗类抗肿瘤药物的临床研发思路与技术要求已较为成熟,但针对多种抗原表位的双抗药物,由于结构与功能存在特殊性,在临床研发中,有其特殊考虑要点。
经总结,《双特异性抗体抗肿瘤药物临床研发技术指导原则》为相关研发企业提供了3个关键参考要点:
① 普遍认为双抗的药效学或生物学作用机制主要包括:桥联细胞、桥联受体、桥联因子;
② 在治疗方面,与单抗相比,双抗可能存在介导免疫细胞对肿瘤的杀伤、增强对免疫细胞的激活、双靶点信号阻断防止耐药、介导更强的内吞作用等潜在优势;
③ 双抗可能以具有生物活性和非活性形式的混合状态存在,此外具有多个结构域,以不同方式介导临床疗效,因此,选择双抗的最佳给药策略需要考虑与两个靶点相关的靶标结合,以及结合动力学对疗效安全性的影响。
全球9款、国内3款,双抗领域前景广阔
与传统单抗相比,双抗优势在于拥有更加精准的靶向和更强的治疗效果,理论上双抗可以发挥“1+1>2”的作用。正是因为其巨大的治疗潜力,双抗药物前景广阔,逐渐成为新药研发和投资的“新宠”。
全球双抗获批上市情况
来源:CDE官网双特异性抗体(BsAb,以下简称“双抗”)是通过细胞融合、重组DNA、蛋白质工程等技术制备的人工抗体,可以同时或先后特异性结合2种抗原或同一抗原的两个不同表位。
双抗作为一类具有双功能的“单药”,既不同于有关的单抗,也不同于单抗的联合用药。单抗类抗肿瘤药物的临床研发思路与技术要求已较为成熟,但针对多种抗原表位的双抗药物,由于结构与功能存在特殊性,在临床研发中,有其特殊考虑要点。
经总结,《双特异性抗体抗肿瘤药物临床研发技术指导原则》为相关研发企业提供了3个关键参考要点:
① 普遍认为双抗的药效学或生物学作用机制主要包括:桥联细胞、桥联受体、桥联因子;
② 在治疗方面,与单抗相比,双抗可能存在介导免疫细胞对肿瘤的杀伤、增强对免疫细胞的激活、双靶点信号阻断防止耐药、介导更强的内吞作用等潜在优势;
③ 双抗可能以具有生物活性和非活性形式的混合状态存在,此外具有多个结构域,以不同方式介导临床疗效,因此,选择双抗的最佳给药策略需要考虑与两个靶点相关的靶标结合,以及结合动力学对疗效安全性的影响。
全球9款、国内3款,双抗领域前景广阔
与传统单抗相比,双抗优势在于拥有更加精准的靶向和更强的治疗效果,理论上双抗可以发挥“1+1>2”的作用。正是因为其巨大的治疗潜力,双抗药物前景广阔,逐渐成为新药研发和投资的“新宠”。
全球双抗获批上市情况
 来源:米内网新版数据库
目前全球共9款双抗药物获批上市,包括罗氏的艾美赛珠单抗及Faricimab、安进生物的贝林妥欧单抗、费森尤斯卡比的卡妥索单抗、康方生物的卡度尼利单抗、强生的Amivantamab、勃林格殷格翰的奥佐利珠单抗等。其中,罗氏的艾美赛珠单抗、安进生物的贝林妥欧单抗以及康方生物的卡度尼利单抗先后在中国市场登陆。
近年来中国三大终端6大市场艾美赛珠单抗、贝林妥欧单抗销售趋势(单位:万元)
来源:米内网新版数据库
目前全球共9款双抗药物获批上市,包括罗氏的艾美赛珠单抗及Faricimab、安进生物的贝林妥欧单抗、费森尤斯卡比的卡妥索单抗、康方生物的卡度尼利单抗、强生的Amivantamab、勃林格殷格翰的奥佐利珠单抗等。其中,罗氏的艾美赛珠单抗、安进生物的贝林妥欧单抗以及康方生物的卡度尼利单抗先后在中国市场登陆。
近年来中国三大终端6大市场艾美赛珠单抗、贝林妥欧单抗销售趋势(单位:万元)
 来源:米内网格局数据库
罗氏的艾美赛珠单抗、安进生物的贝林妥欧单抗分别于2018年11月、2020年12月获NMPA批准上市,均以“符合儿童生理特征的儿童用药品新品种、剂型和规格”纳入优先评审。米内网数据显示,上述产品2021年在中国三大终端6大市场销售额均接近1亿元,分别同比增长13.67%、79.52%。
康方生物的卡度尼利单抗于2022年6月获NMPA批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者,是国内首款、全球首创的PD-1/CTLA-4双特异性免疫治疗药物,也是2022年国谈的热门抗肿瘤药物。
近80款在研双抗蓄势待发,信达、恒瑞……掘金2000亿市场
近年来,随着多个双抗药物的成功上市,以及生物制药技术的不断进步,双抗药物开始步入高速发展阶段,研发热度持续高涨。据米内网统计,目前国内已有近80款双抗药物处于申报临床及以上的研发状态,超过37家国内药企参与布局。
处于临床试验阶段双抗药物达到3款及以上的国内药企
来源:米内网格局数据库
罗氏的艾美赛珠单抗、安进生物的贝林妥欧单抗分别于2018年11月、2020年12月获NMPA批准上市,均以“符合儿童生理特征的儿童用药品新品种、剂型和规格”纳入优先评审。米内网数据显示,上述产品2021年在中国三大终端6大市场销售额均接近1亿元,分别同比增长13.67%、79.52%。
康方生物的卡度尼利单抗于2022年6月获NMPA批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者,是国内首款、全球首创的PD-1/CTLA-4双特异性免疫治疗药物,也是2022年国谈的热门抗肿瘤药物。
近80款在研双抗蓄势待发,信达、恒瑞……掘金2000亿市场
近年来,随着多个双抗药物的成功上市,以及生物制药技术的不断进步,双抗药物开始步入高速发展阶段,研发热度持续高涨。据米内网统计,目前国内已有近80款双抗药物处于申报临床及以上的研发状态,超过37家国内药企参与布局。
处于临床试验阶段双抗药物达到3款及以上的国内药企
 来源:米内网新药研发数据库
从数量上看,信达生物是双抗研发领域的“领军者”,共有8款产品处于临床试验阶段,其中拟用于治疗湿性年龄相关性黄斑变性的IBI-302、以及拟用于治疗T细胞淋巴瘤、皮肤癌的IBI-318已进入Ⅱ期临床。普米斯生物技术(珠海)有6款双抗处于临床试验阶段,其中2款抗肿瘤药PM-8001、PM-8002已进入Ⅱ期临床。除此之外,处于临床试验阶段双抗药物达到3款及以上的药企还有罗氏(4款)、石药控股(4款)、强生(3款)、四川百利天恒药业(3款)、宜明昂科生物(3款)。
国内双抗在研情况
来源:米内网新药研发数据库
从数量上看,信达生物是双抗研发领域的“领军者”,共有8款产品处于临床试验阶段,其中拟用于治疗湿性年龄相关性黄斑变性的IBI-302、以及拟用于治疗T细胞淋巴瘤、皮肤癌的IBI-318已进入Ⅱ期临床。普米斯生物技术(珠海)有6款双抗处于临床试验阶段,其中2款抗肿瘤药PM-8001、PM-8002已进入Ⅱ期临床。除此之外,处于临床试验阶段双抗药物达到3款及以上的药企还有罗氏(4款)、石药控股(4款)、强生(3款)、四川百利天恒药业(3款)、宜明昂科生物(3款)。
国内双抗在研情况


 注:仅统计申请临床及以上阶段
来源:米内网新药研发数据库
从靶点研发热度上看,CD47/PD-L1是国内在研双抗最热门的组合。CD47/PD-L1双抗能同时激活天然免疫和获得性免疫双通路,增强免疫系统对肿瘤的定向识别,协同抗肿瘤;更能同时靶向肿瘤上CD47和PD-L1,精准导航瞄准肿瘤组织,减少毒性,可谓“强强联手、安全有效”。目前,国内已有5款CD47/PD-L1双抗处于临床试验阶段,包括迈威生物的6MW-3211、齐鲁制药的QL-401、百奥泰的BAT-7104、信达生物的IBI-322以及杭州尚健生物的SG-12473,其中,迈威生物的6MW3211(受理号:CXSL2101058)进度较快,已步入Ⅱ期临床。
从研发进度分析,恒瑞医药的SHR-1701、百济神州的Zanidatamab、康方生物的Ivonescimab、康宁杰瑞的KN-046等13款双抗正开展Ⅲ期临床试验,报产将指日可待。其中,恒瑞医药的SHR-1701是研发进度最快的PD-L1/TGFB双抗,若该药成功获批,有望成为同类产品的“first-in-class”。百济神州的Zanidatamab属于HER2双抗,此前已获FDA授予用于HER2基因扩增胆道癌(BTC)患者的突破性治疗认定,以及用于治疗胆道癌和胃癌的孤儿药认定,有望进一步推动国内上市进程。
近年来中国三大终端6大市场抗肿瘤和免疫调节剂销售情况(单位:万元)
注:仅统计申请临床及以上阶段
来源:米内网新药研发数据库
从靶点研发热度上看,CD47/PD-L1是国内在研双抗最热门的组合。CD47/PD-L1双抗能同时激活天然免疫和获得性免疫双通路,增强免疫系统对肿瘤的定向识别,协同抗肿瘤;更能同时靶向肿瘤上CD47和PD-L1,精准导航瞄准肿瘤组织,减少毒性,可谓“强强联手、安全有效”。目前,国内已有5款CD47/PD-L1双抗处于临床试验阶段,包括迈威生物的6MW-3211、齐鲁制药的QL-401、百奥泰的BAT-7104、信达生物的IBI-322以及杭州尚健生物的SG-12473,其中,迈威生物的6MW3211(受理号:CXSL2101058)进度较快,已步入Ⅱ期临床。
从研发进度分析,恒瑞医药的SHR-1701、百济神州的Zanidatamab、康方生物的Ivonescimab、康宁杰瑞的KN-046等13款双抗正开展Ⅲ期临床试验,报产将指日可待。其中,恒瑞医药的SHR-1701是研发进度最快的PD-L1/TGFB双抗,若该药成功获批,有望成为同类产品的“first-in-class”。百济神州的Zanidatamab属于HER2双抗,此前已获FDA授予用于HER2基因扩增胆道癌(BTC)患者的突破性治疗认定,以及用于治疗胆道癌和胃癌的孤儿药认定,有望进一步推动国内上市进程。
近年来中国三大终端6大市场抗肿瘤和免疫调节剂销售情况(单位:万元)
 来源:米内网格局数据库
从治疗大类上看,抗肿瘤和免疫调节剂居多,共有71款药品正在开展临床研究;感觉系统药物有3款,血液和造血系统药物有2款,消化系统及代谢药、全身用抗感染药物各有1款均已进入临床试验阶段。米内网数据显示,抗肿瘤和免疫调节剂2021年在中国三大终端6大市场的销售规模突破2000亿元,同比增长12.52%,预计2022年有望再创新高。
三大要点助力研发企业弯道突围
大热的双抗药物研发赛道,中国药企该如何突围、实现弯道超越?笔者认为可从“靶点筛选、工艺提升、研发加速”三个方面入手:
① 着力生物机制和靶点筛选双靶点会引起更复杂的作用机制,可能会带来潜在的未知安全隐患,这些风险在临床前研究时很难被预测。研究者必须要对配对的靶点有深刻的理解,筛选出合适的双抗基础结构,并且满足亲和力、药代动力学的各种指标,结构改动越少的双抗具备更合适的稳定性和溶解度,更易实现“1+1>2”的效果。
② 提升抗体开发及工艺技术在技术层面,双抗的技术难点在于结构设计和链的匹配,这并非两个单抗联合在一起就能解决的问题,随着国家药监局对于以临床需求为导向的指导,过去意图通过简单的联合就研发出双抗的时代已不复存在。以临床需求为导向的大趋势,将倒逼研发企业的双抗平台需具备易于后续药品开发的特性,以及稳定高效的抗体技术;在工艺层面上,持续优化结构将有利于双抗的提纯。
③ 缩短研发周期,为产品商业化赢取先机任何市场、任何产品,赢得先发优势是至关重要的,双抗领域也不例外。因此,被选择的候选药物要满足临床试验和开发的多个标准,即满足临床疗效,高安全性,药效/药代动力学参数合适,良好的物化性质,可放大生产,免疫原性低等。具有优良性质的双抗显然可以降低CMC(药品的化学、制造和控制)开发难度并缩短研发周期,为产品商业化赢得先机。
结语
双抗药物是单抗药物的升级产品,并逐渐成为肿瘤及免疫治疗药物的重要发展方向。现阶段全球及国内多个药企对双抗药物的研发极为重视,已研发问世并进入临床的药物种类不断增多。在临床研发中,我们后续需要关注首次人体临床试验的风险控制、最佳给药策略、免疫原性、生物标志物的开发等问题。随着双抗药物陆续获批上市,同时已上市双抗获批更多适应症,数据预测显示,双抗的全球市场规模在2025年将超过500亿元。市场前景一片趋好的形势下,后来者想要在火热的双抗赛道上突围而出,减少同质化竞争、寻求差异化产品显然是必不可少的。
来源:米内网数据库、CDE官网注:米内网《中国三大终端6大市场药品竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至12月9日,如有疏漏,欢迎指正!
来源:米内网格局数据库
从治疗大类上看,抗肿瘤和免疫调节剂居多,共有71款药品正在开展临床研究;感觉系统药物有3款,血液和造血系统药物有2款,消化系统及代谢药、全身用抗感染药物各有1款均已进入临床试验阶段。米内网数据显示,抗肿瘤和免疫调节剂2021年在中国三大终端6大市场的销售规模突破2000亿元,同比增长12.52%,预计2022年有望再创新高。
三大要点助力研发企业弯道突围
大热的双抗药物研发赛道,中国药企该如何突围、实现弯道超越?笔者认为可从“靶点筛选、工艺提升、研发加速”三个方面入手:
① 着力生物机制和靶点筛选双靶点会引起更复杂的作用机制,可能会带来潜在的未知安全隐患,这些风险在临床前研究时很难被预测。研究者必须要对配对的靶点有深刻的理解,筛选出合适的双抗基础结构,并且满足亲和力、药代动力学的各种指标,结构改动越少的双抗具备更合适的稳定性和溶解度,更易实现“1+1>2”的效果。
② 提升抗体开发及工艺技术在技术层面,双抗的技术难点在于结构设计和链的匹配,这并非两个单抗联合在一起就能解决的问题,随着国家药监局对于以临床需求为导向的指导,过去意图通过简单的联合就研发出双抗的时代已不复存在。以临床需求为导向的大趋势,将倒逼研发企业的双抗平台需具备易于后续药品开发的特性,以及稳定高效的抗体技术;在工艺层面上,持续优化结构将有利于双抗的提纯。
③ 缩短研发周期,为产品商业化赢取先机任何市场、任何产品,赢得先发优势是至关重要的,双抗领域也不例外。因此,被选择的候选药物要满足临床试验和开发的多个标准,即满足临床疗效,高安全性,药效/药代动力学参数合适,良好的物化性质,可放大生产,免疫原性低等。具有优良性质的双抗显然可以降低CMC(药品的化学、制造和控制)开发难度并缩短研发周期,为产品商业化赢得先机。
结语
双抗药物是单抗药物的升级产品,并逐渐成为肿瘤及免疫治疗药物的重要发展方向。现阶段全球及国内多个药企对双抗药物的研发极为重视,已研发问世并进入临床的药物种类不断增多。在临床研发中,我们后续需要关注首次人体临床试验的风险控制、最佳给药策略、免疫原性、生物标志物的开发等问题。随着双抗药物陆续获批上市,同时已上市双抗获批更多适应症,数据预测显示,双抗的全球市场规模在2025年将超过500亿元。市场前景一片趋好的形势下,后来者想要在火热的双抗赛道上突围而出,减少同质化竞争、寻求差异化产品显然是必不可少的。
来源:米内网数据库、CDE官网注:米内网《中国三大终端6大市场药品竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至12月9日,如有疏漏,欢迎指正!